Peut-on mesurer le risque de contamination à l’Université ?
La reprise des activités universitaires en présentiel dépend de paramètres extrêmement divers, sur lesquels l’Université n’a pas toujours les moyens d’agir : désorganisation ambiante, restrictions de circulation pour l’ensemble de la population, précarité étudiante qui conduit à repartir vivre chez les parents loin des campus… mais aussi peur du retour et angoisse diffuse face au risque de contamination. Dans le même temps, les difficultés logistiques d’organisation d’un retour partiel prouvent que cette reprise en présentiel, pour être viable, doit concerner toutes les activités et tous les étudiants. Une approche rationnelle de la crise sanitaire à l’Université, comme celle que nous prônons depuis septembre, ne peut pas s’accommoder de proclamations selon lesquelles les établissements ne seraient par essence « pas des clusters », ni de l’optimisme de bon aloi des présidents pour qui tout serait prêt sans avoir à concéder le moindre investissement sérieux supplémentaire.
Dans ce billet, nous souhaitons reprendre le fil d’une stratégie systématique qui viserait à faire décroitre les contaminations jusqu’à épuisement du réservoir épidémique humain puis à endiguer toute résurgence. Pour abaisser le taux de reproduction épidémique en dessous de 1, il est primordial de pouvoir mesurer les risques de contamination pour éliminer les voies de contagions dominantes et reprendre, avec un risque contrôlé, les activités qui ne présentent pas de danger significatif.
Pour l’Université, le calcul de risque est relativement simple. En effet, la transmission par fomites, par les fèces et par les postillons est rendue négligeable par les précautions d’usage si elles sont respectées. Elles doivent donc être rappelées, et encouragées : nettoyage des surfaces et des mains, abaissement de la lunette des toilettes avant de tirer la chasse pour éviter l’aérosolisation, et port du masque. Une fois ces prérequis pris en compte, la transmission résiduelle est essentiellement aéroportée.
La probabilité de contamination dépend de la dose virale, qui se définit comme la quantité cumulée de particules virales inhalées. Plus la concentration en particules virales et plus le temps d’exposition sont importants, plus la probabilité de contamination est grande. On définit un quantum infectieux comme la dose moyenne pour une population donnée qui conduit à une probabilité de contamination égale à 1-1/e=63%. Si le quantum infectieux est l’unité la plus commode pour exprimer une dose virale, cette moyenne pertinente pour le calcul de risque recouvre une grande variabilité des systèmes immunitaires (réponse interféron) entre individus.
Pour une activité donnée, on peut estimer le taux moyen de particules virales infectieuses émises dans l’air par un individu asymptomatique ou pré-symptomatique : autour de 40 quanta/heure pour des étudiants, significativement plus pour un enseignant faisant cours en amphi. Ces particules virales se diluent dans l’air dans les mêmes proportions que le CO2 émis par la respiration. Le taux de CO2 dans l’air, aisément mesurable, reflète ainsi le niveau de ventilation des pièces, c’est-à-dire le taux de remplacement d’air vicié par de l’air frais. Dans l’hypothèse communément admise où l’attaque virale constitue un processus de Poisson, hypothèse qui donne une borne supérieure au risque, le nombre moyen de personnes contaminées par une personne atteinte est proportionnel au temps d’exposition et au taux de CO2 excédentaire par rapport à l’air extérieur [1]. La constante multiplicative entre les deux dépend de la réduction des doses émises et inhalées selon que l’on porte ou pas un masque.
Les hypothèses de calcul étant posées, allons au résultat. Le risque, défini comme la probabilité qu’une personne atteinte en contamine une autre du fait de l’activité universitaire, ne dépend que du débit d’air frais par nombre de personnes présentes ou, plus précisément, que du taux de CO2. Le résultat est plus subtil qu’il n’y paraît, puisque tous les occupants de la salle exhalent du CO2 mais que seules les personnes infectées exhalent du virus. Comparons le risque d’un cours en amphithéâtre bien ventilé (750 ppm de CO2), avec 50 étudiants à celui où les mêmes étudiants sont répartis dans deux salles classiques avec le même taux de CO2. À l’évidence, toutes choses égales par ailleurs, la probabilité qu’un étudiant soit infectieux est deux fois plus faible quand 25 étudiants sont rassemblés, plutôt que 50. Cependant, la ventilation étant proportionnée à la jauge de la salle, les particules virales sont deux fois plus concentrées dans la petite salle et donc les doses inhalées doublent. Sous l’hypothèse ci-dessus, le nombre moyen de personnes contaminées est le même, bien que le risque se répartisse différemment.
Pendant une heure de cours, dans une salle mal ventilée (1000 ppm de CO2), le risque est de 7% avec des masques en tissu, de 0,7% avec des masques chirurgicaux bien portés, de 0,1% avec des masques FFP2 bien portés. Dans une salle bien ventilée (650 ppm de CO2) avec des FFP2, le risque tombe à 0,06%. En comptant 25 heures de cours par semaine, une personne atteinte du variant B1.1.7 « anglais » contamine alors 0,02 personnes pendant les 10 jours où elle est infectieuse, ce qui est petit devant 1, seuil du taux de reproduction épidémique. Dans un lieu de restauration collectif mal ventilé (1000 ppm de CO2), sans masque, le nombre de contaminés par personne infectée, en 10 jours de déjeuners (7 repas d’une demi-heure), est de 2, soit 100 fois plus que de suivre les cours.
Conclusion. Il n’existe aucune raison scientifique de ne pas reprendre les enseignements à l’Université, quand l’effort pour sécuriser les espaces dédiés ne consiste qu’à acheter quelques centaines de capteurs de CO2, des masques FFP2 en gros, à réviser les ventilations et à apprendre à ouvrir les fenêtres et les portes quand le taux de CO2 s’élève. Nous avons les moyens scientifiques et techniques de reprendre l’enseignement dans de bonnes conditions, en contrôlant le niveau de risque. Il ne reste à l’exécutif qu’à adopter une démarche rationnelle, à débloquer des moyens budgétaires pour mettre en œuvre une réduction du risque de contamination et à accepter enfin l’aide proposée par les scientifiques.
En revanche, la sécurisation sanitaire des espaces de convivialité et des lieux de restauration collective est d’une toute autre difficulté. Seule la distribution de repas chauds en plein air est facile à mettre en œuvre à court terme. Un travail de fond sur les aspects humains de ces temps de partage, mettant en regard la complexité des comportements sociaux dans l’Université et la propagation du virus, serait nécessaire, afin d’apporter sur le temps long un éclairage objectif et d’identifier des pistes d’action qui permettent de retrouver une vie universitaire respectueuse des libertés de chacun, sans mettre en danger autrui. En s’enrichissant des apports et de la diversité de nos champs disciplinaires, la communauté de recherche est à même de se saisir de ces questions transversales, et de les développer avec les étudiants. Doubler ce chantier interdisciplinaire d’une expérience pratique de formation par la recherche nous donne une chance de reprendre ensemble le contrôle de nos vies. Nous avons désespérément besoin d’ouvrir des perspectives d’avenir, de dessiner des horizons positifs.
[1] Sous l’hypothèse d’un mélange efficace, la dose virale reçue par un individu est donnée par la règle de proportionnalité suivante :
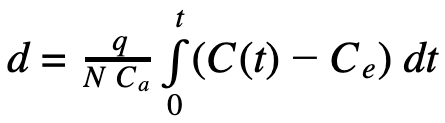
où Ca= 37 500 ppm est la concentration typique en CO2 dans l’air expiré, q le taux d’émission de virus en quanta/h et N le nombre de personnes dans la pièce. d étant exprimé en quanta d’infection, le nombre moyen de personnes infectées vaut N(1-e-d), qui se simplifie en :
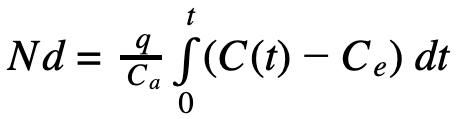
à faible dose d’infection i.e. à d petit. Le résultat est remarquable : la probabilité de contamination ne dépend du volume de la pièce, de la ventilation et du nombre de personnes présentes qu’au travers de la concentration en CO2.
Deux références importantes :
Sze To GN, Chao CY. Review and comparison between the Wells–Riley and dose‐response approaches to risk assessment of infectious respiratory diseases. Indoor Air. 2010 , 20(1):2-16.
Buonanno, G.; Stabile, L.; Morawska, L. Estimation of airborne viral emission: quanta emission rate of SARS-CoV-2 for infection risk assessment. Environment International 2020, 141, 105794.